
2022年5月1日,鲲石生物团队在预印本网站bioRxiv上发布了未经同行评审的题为“TME induced TRAIL secretion from engineeredmacrophages for anti-tumor therapy ”的研究。在该项工作中,鲲石生物科技(深圳)有限公司为文章的第一单位,中国医科大学盛京医院全科医学系,解放军总医院医学创新研究部生物工程研究中心分别为第二、三单位,鲲石生物员工黄馨、邓博天为共同第一作者,公司其他员工周慧、史滨河、刘军花、单晓娇、房晓彬等人作为共同作者,参与该项工作。鲲石生物创始人尹秀山教授及解放军总医院张硌教授为文章通讯作者。

以巨噬细胞递送趋化因子或细胞因子的细胞药物载体已被广泛用于组织稳态和癌症抑制治疗。巨噬细胞是高度塑化的细胞,具有多种功能,包括组织发育和内环境稳定、清除细胞碎片、清除病原体和调节炎症反应。由肿瘤细胞和肿瘤相关基质细胞产生的细胞因子,如单核细胞趋化蛋白1(MCP-1,也称为CCL-2)、巨噬细胞集落刺激因子(M-CSF)可以将单核细胞/巨噬细胞招募到肿瘤微环境中。由于巨噬细胞载体对肿瘤部位的亲和力,它们是药物输送到肿瘤的有吸引力的候选者。各种巨噬细胞介导的细胞载体被设计用于治疗肿瘤转移和实体瘤。然而,以前的研究大多属于持续的细胞递送,导致非肿瘤组织损伤和系统性副作用,这使得该策略需要进一步改进。
肿瘤坏死因子相关的细胞凋亡诱导配体(TRAIL)是一种很有前途的抗肿瘤细胞因子,能够促进肿瘤细胞凋亡,并且对正常细胞无明显杀伤作用。尹秀山教授团队设计了在肿瘤微环境(TME)中特异性表达和分泌癌症细胞毒性蛋白通路的巨噬细胞——Tri-TRAIL-iM。其特点是能够在TME特异性启动子Arg1诱导下分泌三聚化的TRAIL。同时,分泌的TRAIL能够诱导巨噬细胞本身转化为促炎型巨噬细胞,进一步杀伤肿瘤组织。此外,在Arg1启动子的作用下,Tri-TRAIL-iM只在肿瘤环境下,转化为促炎型巨噬细胞。
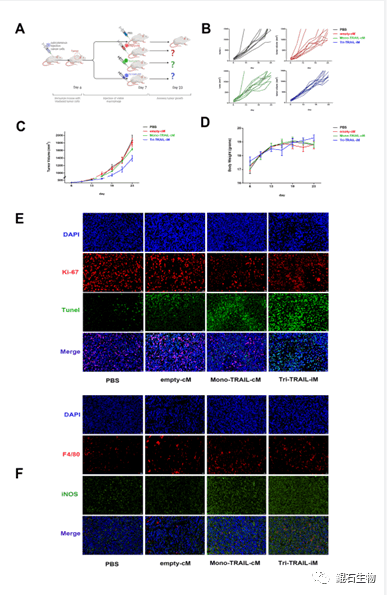
Tri-TRAIL-iM在基于肿瘤细胞的共培养试验和小鼠肿瘤模型中均显示出高度诱导活性,具有明显的杀伤效果。与非诱导启动子下的正常TRAIL过表达的巨噬细胞相比,Tri-TRAIL-iM显示出优越的肿瘤细胞凋亡诱导和肿瘤生长抑制以及较少的系统性副作用。其次,由于高度这种诱导递送试验策略可有效地进一步应用于临床研究,并可与其他工程方法结合,以最大限度地提高实体瘤的治疗效果。
Del-M平台由鲲石生物自主研发,是鲲石生物三大平台一个数据库的研发布局四大板块之一,该项工作是Del-M平台的持续产出成果。除了肿瘤组织特异递送TRAIL,靶向实体瘤递送平台的3个相关管线也在顺利进行中。鲲石生物专注于研发靶向实体瘤的新型嵌合抗原受体巨噬细胞(CAR-M)药物,目前主要针对乳腺癌、肺癌及胃癌等实体瘤,布局以巨噬细胞药物为核心的闭环产业链模式,实现巨噬细胞在临床上的转化及应用,致力于做CAR-M全球引领型企业及规范制定者。
原文链接:https://www.biorxiv.org/content/10.1101/2022.04.30.490137v1
Drag & Drop Website Builder